La materia

Preguntas
1. ¿Qué es la materia?
Es aquello de lo que están hechos los objetos que constituyen el Universo y que podemos ver y tocar. También son las cosas que no podemos ver, como el aire.
Observamos que la materia ocupa una cierta porción de espacio que llamamos volumen.
Comentario: “Mi comentario es que en la materia es todo lo que existe a nuestro alrededor y que se puede ver a simple vista también lo q no podemos ver es materia como en caso del aire”
- http://newton.cnice.mecd.es/1eso/materia/index.html
- http://es.wikipedia.org/wiki/Materia#Concepto_F.C3.ADsico
2. ¿Cuántos tipos de materia hay?
Los tipos de materia son:
Materia orgánica:
Compuestos orgánicos, son sustancias químicas basadas en cadenas de carbono e hidrógeno. En muchos casos contienen oxígeno, y también nitrógeno, azufre, fósforo, boro y halógenos. No son moléculas orgánicas los carburos, los carbonatos y los óxidos de carbono.
- Materia orgánica natural: Son las sintetizadas por los seres vivos, y se llaman biomoléculas, las cuales son estudiadas por la bioquímica.
- Materia orgánica artificial: Son sustancias que no existen en la naturaleza y han sido fabricadas por el hombre como los plásticos. La mayoría de los compuestos orgánicos puros se producen artificialmente.
http://es.wikipedia.org/wiki/Compuesto_orgánico
Materia inorgánica:
Sustancias de origen mineral cuya estructura no está constituida principalmente por el carbono y sin procesos metabólicos vitales, como son todos los minerales, y que no pueden crecer sino por yuxtaposición.
-http://www.infojardin.net/glosario/magnesio/materia-inorganica.htm
Comentario: Mi comentario es deque la materia tiene dos tipos que son la orgánica, son sustancia química que están constituidas por el carbono e hidrogeno, además se dividen en natural y artificial y la natural son como el oxigeno, hidrogeno, etc. y la artificial son inventadas y que la mayoría de las sustancias orgánicas son artificiales, y la inorgánica no esta constituida por el carbono y no puede crecer sino por yuxtaposición
El Átomo

Preguntas
1. ¿Qué es el Átomo?
Es la unidad más pequeña de todo elemento químico que mantiene su identidad o sus propiedades y que no es posible de dividir mediante procesos químicos.
Comentario: Mi comentario es que la materia no puede ser dividida en infinitas partes por procesos químicos.
Átomo - Wikipedia, la enciclopedia libre
2. ¿Cuál es la estructura del átomo?
En el átomo encontramos dos partes: el núcleo y la corteza.
- El núcleo: Es la parte central del átomo y contiene partículas con carga positiva, los protones, y partículas que no poseen carga eléctrica, es decir son neutras, los neutrones. La masa de un protón es aproximadamente igual a la de un neutrón.
- La corteza: Es la parte exterior del átomo. En ella se encuentran los electrones, con carga negativa. Éstos, ordenados en distintos niveles, giran alrededor del núcleo. La masa de un electrón es unas 2000 veces menor que la de un protón.
Conclusión: Mi conclusión es que el átomo se divide en núcleo, que es la parte central del átomo y que esta constituida por protones(carga positiva) y neutrones y q hay se encuentra toda la carga positiva, y la corteza, esta constituida por los electrones (carga negativa).
3. ¿Cuál es el origen del átomo? (Teorías)
El concepto de átomo existe desde la Antigua Grecia propuesto por los filósofos griegos Demócrito y Leucipo, sin embargo, no se generó el concepto por medio de la experimentación sino como una necesidad filosófica que explicara la realidad, ya que, como proponían estos pensadores, la materia no podía dividirse indefinidamente, por lo que debía existir una unidad o bloque indivisible e indestructible que al combinarse de diferentes formas creara todos los cuerpos macroscópicos que nos rodean.
Después el filósofo Aristóteles rechazo la filosofía de Leucipo y Demócrito debido a que Aristóteles dijo que la materia se podía dividir en infinitamente y que eran cuatro elementos: agua, tierra, aire y fuego.
John Dalton (1766-1844)

Nació el 6 de septiembre de 1766. Con 12 años, en 1778, comenzó a impartir enseñanza elemental en Cumberland, y a partir de 1780 lo hizo en Kendal durante 12 años más.
En 1792, a la edad de 26 años se trasladó a Manchester, donde impartió matemáticas y filosofía natural en el New College.
En 1793 inició sus estudios sobre meteorología, recopilando a lo largo de su vida más de 200.000 anotaciones, y ese mismo año publicó Observaciones y Ensayos de Meteorología. En sus estudios sobre la meteorología desarrolló varios instrumentos de medición y propuso por primera vez que el origen de la lluvia se encuentra en el descenso de la temperatura. En este ámbito estudió también las auroras boreales, y determinó que éstas están relacionadas con el magnetismo de
Estudió la enfermedad que padecía, conocida como acromatopsia y posteriormente llamada daltonismo en su honor, y publicó Extraordinary Facts Relating to the Vision of Colours (1794). A partir de 1800 pasó a la enseñanza privada y ocupó el cargo de secretario de
Fue alumno suyo el también físico James Prescott Joule, que más tarde efectuó estudios sobre magnetismo y que puso las bases para el desarrollo de las leyes sobre la conservación de la energía (termodinámica).
En 1801 enunció la ley de las presiones parciales y la de las proporciones múltiples.
En 1805 expuso la teoría atómica en la que se basa la ciencia física moderna. Demuestra que la materia se compone de partículas indivisibles llamadas átomos. También ideó una escala de símbolos químicos.
El primer modelo atómico fue formulado por Jhon Dalton en 1808. Formulo unos postulados y son los siguientes:
![]() La materia está formada por partículas muy pequeñas llamadas átomos, que son indivisibles y no se pueden destruir.
La materia está formada por partículas muy pequeñas llamadas átomos, que son indivisibles y no se pueden destruir.
![]() Los átomos de un mismo elemento son iguales entre sí, tienen su propio peso y cualidades propias. Los átomos de los diferentes elementos tienen pesos diferentes.
Los átomos de un mismo elemento son iguales entre sí, tienen su propio peso y cualidades propias. Los átomos de los diferentes elementos tienen pesos diferentes.
![]() Los átomos permanecen sin división, aún cuando se combinen en las reacciones químicas.
Los átomos permanecen sin división, aún cuando se combinen en las reacciones químicas.
![]() Los átomos, al combinarse para formar compuestos guardan relaciones simples.
Los átomos, al combinarse para formar compuestos guardan relaciones simples.
![]() Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto.
Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto.
![]() Los compuestos químicos se forman al unirse átomos de dos o más elementos distintos.
Los compuestos químicos se forman al unirse átomos de dos o más elementos distintos.
Falleció en Manchester en 1844, a la edad de 78 años. Más de 40.000 personas acudieron al funeral para presentar sus respetos al científico.

J.J Thomson (1856-1940)

Nació el 18 de diciembre de 1856 cerca de Manchester, Lancashire. Con catorce años ingresó en Owens Collage (hoy parte de
Ejerció como profesor de física experimental y director del Laboratorio Cavendish. Fue presidente de
En 1906, obtuvo el Premio Nobel de Física por sus trabajos sobre la conducción de la electricidad a través de los gases. En 1908, fue nombrado Sir.
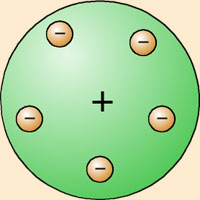
Se le considera el descubridor del electrón por sus experimentos con el flujo de partículas (electrones) que componen los rayos catódicos. Teórico y habilísimo experimentador, estudió a fondo dichos rayos catódicos. Después de haber demostrado claramente su naturaleza corpuscular, demostró asimismo, que tales partículas están cargadas negativamente; cuantificó directamente su energía y, en 1897, con un célebre experimento, determinó la relación entre su carga y su masa. Al año siguiente, cuantificó también su carga, que demostró que era igual a la de los iones hidrógeno pero de signo opuesto. Sobre la base de estos resultados propuso, en 1904, la identificación por J.J. Thomson de unas partículas subatómicas cargadas negativamente, los electrones, a través del estudio de los rayos catódicos, y su posterior caracterización, le llevaron a proponer un modelo de átomo que explicara dichos resultados experimentales. Se trata del modelo conocido informalmente como el pudín de ciruelas, según el cual los electrones eran como 'ciruelas' negativas incrustadas en un 'pudín' de materia positiva.
Ernest Rutherford (1871-1937)

Nació el 30 de agosto de 1871, en Nelson, Nueva Zelanda. Hijo de un granjero, fue el cuarto de once hermanos. Tras licenciarse, en 1893, en Christchurch (Nueva Zelanda), se trasladó a
Rutherford recibió el Premio Nobel de Química de 1908 en reconocimiento a sus investigaciones relativas a la desintegración de los elementos. Entre otros honores, fue elegido miembro (1903) y presidente (1925-1930) de
Por sus trabajos en el campo de la física atómica está considerado como uno de los padres de esta disciplina. Tras el descubrimiento de la radiactividad en 1896 por Henri Becquerel, estudió las emisiones radioactivas e identificó sus tres componentes principales a los que denominó rayos alfa, beta y gamma. Demostró (1908) que las partículas alfa son núcleos de helio.
Quizás su contribución más importante a la física fueron sus estudios sobre la dispersión de los rayos alfa producida al bombardear con ellos láminas delgadas de metales. Esta investigación le condujo, en
En 1911 Rutherford y sus colaboradores bombardearon una fina lámina de oro con partículas alfa (núcleos de helio) procedentes de un elemento radiactivo. Observaban, mediante una pantalla fluorescente, en qué medida eran dispersadas las partículas. La mayoría de ellas atravesaba la lámina metálica sin cambiar de dirección; sin embargo, unas pocas eran reflejadas hacia atrás con ángulos pequeños. Éste era un resultado completamente inesperado, incompatible con el modelo de atómo macizo existente.
Mediante un análisis matemático de las fuerzas involucradas, Rutherford demostró que la dispersión era causada por un pequeño núcleo cargado positivamente, situado en el centro del átomo de oro. De esta forma dedujo que la mayor parte del átomo es espacio vacío, lo que explicaba por qué la mayoría de las partículas que bombardeaban la lámina de oro, pasaran a través de ella sin desviarse.
Durante su último año en Manchester (1919) logró la primera transmutación artificial de elementos químicos mediante el bombardeo con partículas alfa de nitrógeno, que se transformó durante el proceso en un isótopo del oxígeno.


Niels Bohr (1885-1962

Fruto de esta cooperación fue la publicación, en 1913, del llamado "modelo atómico de Bohr", resultado de la combinación del modelo atómico del propio Rutherford y de los postulados de la teoría de los cuantos de M. Planck. Este modelo atómico le valió el Premio Nobel de Física en 1922.
En 1916 regresa a Copenhague, donde ocupa una plaza de profesor en
A partir de 1925, jóvenes físicos como Heisenberg, Dirac... fueron a trabajar con Bohr en
L
En 1945, concluida la contienda mundial, regresa a

Conclusión: Mi conclusión es que el átomo se origino con el pensamiento filosófico de Leucipo y Democrito que trataba sobre que la división de la materia tenia un limite a la cual le denominaron “átomo”, pero después Aristóteles rechazo esa teoría y dijo que la materia era infinita y que se dividía en agua, tierra, aire, fuego. Después de unos años John Dalton con una base científica demostró que la materia tenía un límite y era el átomo que su masa era positiva. Pasaron los años y J.J.Thomson descubrió que el átomo no era solo masa positiva sino que tenia cargas negativas que rodeaban al núcleo. Así prosiguió Rutherford con su teoría que trato de que bombardeo una lámina de oro con rayos alfa beta y gamma, dio a conocer que el átomo tenia vacíos. Bhor desmostro que el átomo tenia niveles de energía negativa.
Elementos Químicos:

Preguntas
1. ¿Qué son los elementos químicos?
Es una sustancia que no puede ser descompuesta o dividida en sustancias más simples por medios químicos ordinarios. Antiguamente, los elementos se consideraban sustancias fundamentales, pero hoy se sabe que consisten en una variedad de partículas elementales: electrones, protones y neutrones.
Conclusión: Mi conclusión es que los elementos químicos son sustancias que no pueden ser descompuestas por sustancias más simples y que se consideraban sustancias fundamentales.
2. ¿Cómo es la cronología de la tabla periódica?
Döbereiner
Este químico alcanzó a elaborar un informe que mostraba una relación entre la masa atómica de ciertos elementos y sus propiedades en 1817. Él destaca la existencia de similitudes entre elementos agrupados en tríos que él denomina “tríadas”. La tríada del cloro, del bromo y del yodo es un ejemplo. Pone en evidencia que la masa de uno de los tres elementos de la triada es intermedia entre la de los otros dos. En 1850 pudimos contar con unas 20 tríadas para llegar a una primera clasificación coherente.
Chancourtois y Newlands
En 1862 Chancourtois, geólogo francés, pone en evidencia una cierta periodicidad entre los elementos de la tabla. En 1864 Chancourtois y Newlands, químico inglés, anuncian la Ley de las octavas: las propiedades se repiten cada ocho elementos. Pero esta ley no puede aplicarse a los elementos más allá del Calcio. Esta clasificación es por lo tanto insuficiente, pero la tabla periódica comienza a ser diseñada.
Meyer
En 1869, Meyer, químico alemán, pone en evidencia una cierta periodicidad en el volumen atómico. Los elementos similares tienen un volumen atómico similar en relación con los otros elementos. Los metales alcalinos tienen por ejemplo un volumen atómico importante.
Mendeleïev
En 1869, Mendeleïev, químico ruso, presenta una primera versión de su tabla periódica en 1869. Esta tabla fue la primera presentación coherente de las semejanzas de los elementos. El se dio cuenta de que clasificando los elementos según sus masas atómicas se veía aparecer una periodicidad en lo que concierne a ciertas propiedades de los elementos. La primera tabla contenía 63 elementos.
Comentario: Mi comentario es que la cronología de la tabla periódica tiene que ver con el comienzo de las “triadas” (grupos de similitudes en trios) por el químico Döbereiner como por ejemplo la triada del oro, bromo y yodo. Siguiendo con Chancourtois y Newlands con las “octavas” (propiedades que se repiten cada ocho elementos) y que la ley no puede aplicarse con los elementos que siguen después del calcio. Meyer pone una cierta periodicidad en el volumen atómico donde relaciona el volumen atómico con los otros elementos, y por último Mendeleïev quien propuso la tabla periódica más coherente que clasifico a los elementos químicos por sus masas atómicas y la primera tabla tuvo 63 elementos.
http://www.lenntech.com/espanol/tabla-peiodica/historia-de-la-tabla-periódica.htm
3. ¿Quién propuso la tabla periódica?
La tabla periódica de los elementos fue propuesta por Dimitri Mendeleiev y Julius Lothar Meyer quienes, trabajando por separado, prepararon una ordenación de todos los elementos conocidos, basándose en la variación sistemática de las propiedades químicas (Mendeleyev) y físicas (Meyer) con la variación de sus masas atómicas. A diferencia de lo que había supuesto Newlands, en
Conclusión: Mi conclusión es que la tabla periódica fue propuesta por Mendeleiev en 1869 y estaba dividida en grupos (columnas verticales) a las cuales le correspondían periodos.
http://es.wikipedia.org/wiki/Tabla_periódica_de_los_elementos
4. ¿Qué son grupos y periodos y en cuantos se divide se divide la tabla periódica?
Grupos: Conjunto de elementos ordenados en forma de columnas verticales, que reunen elementos de propiedades similares, numerados del 1 al 18.
Los grupos de
Grupo 1 (IA): los metales alcalinos
Grupo 2 (IIA): los metales alcalinotérreos
Grupo 3 al Grupo 12: los metales de transición y metales nobles.
Grupo 13 (IIIA): el grupo del boro
Grupo 14 (IVA): el grupo del carbono
Grupo 15 (VA): el grupo del nitrógeno
Grupo 16 (VIA): los calcógenos o anfígenos
Grupo 17 (VIIA): los halógenos
Grupo 18 (Grupo 0): los gases nobles
Período: Indica la cantidad de niveles de energía en que se hallan distribuidos los electrones de un elemento.
La tabla periódica tiene siete períodos:
Conclusión: Mi conclusión es que los grupos son elementos que están en columna vertical y que tienen propiedades similares y los periodos indican la cantidad de energía que hayan distribuido los electrones en un elemento
http://es.wikipedia.org/wiki/Tabla_periódica_de_los_elementos#Tabla_peri.C3.B3dica_de_Mendeleiev
http://www.fortunecity.com/campus/dawson/196/tabla.htm
Sustancias
1. ¿Qué es una sustancia?
Es toda porción de materia que comparte determinadas propiedades intensivas.
Conclusión: He llegado a la conclusión de que la sustancia es una porción de la materia que comparte determinadas propiedades intensivas.
http://es.wikipedia.org/wiki/Sustancia
2. ¿Qué son sustancias puras y en que se dividen?
Se denomina sustancia pura (llamada así para distinguirla de una mezcla) a todo aquel sistema homogéneo que posea un sólo componente.
· Una sustancia simple: Es aquella sustancia pura que está formada por átomos de un único elemento en sus posibles estados alotrópicos.
· Una sustancia compuesta: Es aquella sustancia pura en cuya composición encontramos varias clases de átomos en una proporción constante.
Conclusión: Es de que la sustancia pura es distinta a una mezcla y que se divide en simple, esta formada por átomos de un único elemento en sus posibles estados alotrópicos, y compuestas, encontramos varias clases de átomos en una proporción constante.
3. ¿Qué es experimentación?
Es un método común de las ciencias y las tecnologías, consiste en el estudio de un fenómeno, reproducido generalmente en un laboratorio, en las condiciones particulares de estudio que interesan, eliminando o introduciendo aquellas variables que puedan influir en él. Se entiende por variable todo aquello que pueda causar cambios en los resultados de un experimento y se distingue entre variable independiente, dependiente y controlada.
Conclusión: Consiste en el estudio de un fenómeno, hecho generalmente en un laboratorio en condiciones particulares eliminado o introduciendo aquellas variables que puedan influir en él.
http://es.wikipedia.org/wiki/Experimentación
4. ¿Qué es una mezcla?
Son materiales formados por dos o más sustancias en proporciones variables que conservan sus propiedades; las sustancias intervienen en cantidades variables; sus componentes pueden separarse por medios físicos (destilación, evaporación, cristalización, etc),
Conclusión: Es que la mezcla esta formada por 2 o más sustancias en proporciones variables que conservan sus propiedades.
http://es.wikipedia.org/wiki/Mezcla
5. ¿En qué se clasifican las mezclas?
Se dividen en:
Mezclas Homogéneas: (llamadas también soluciones), tienen apariencia uniforme y solo se ven como una sola fase. Presentan iguales propiedades en todos sus puntos. Se separan por cristalización, extracción, destilación y cromatografía. Estas mezclas se conocen más genéricamente como soluciones. Una solución está constituida por un “solvente”, que es el componente que se halla en mayor cantidad o proporción y uno o más “solutos”, que son las sustancias que se hallan dispersas homogéneamente en el solvente. El solvente universal es el agua, puede estar a una proporción de 40/60 y el agua continua siendo el solvente en esa mezcla. Las partículas del soluto son tan pequeñas (moléculas, átomos o iones) que no se pueden ver ni siquiera con un ultramicroscopio.
Mezclas Heterogéneas: Presentan un aspecto no uniforme. Se separan por filtración, decantación y por separación magnética. Están formadas por dos o más sustancias puras que se combinan, conservando cada una sus propiedades particulares, de tal manera que podemos distinguir las sustancias que la componen.
Conclusión: Es de que las mezclas homogéneas se tienen apariencia uniforme, solo se ven como una fase y presentan iguales propiedades en todos sus puntos, y las heterogéneas presentan un aspecto no uniforme y se separan por filtración, decantación y por separación magnética.
